بقلم بريان باكمان ، بروفسور الكيمياء في جامعة فاندربيلت
٤ أكتوبر ٢٠١٨ :
المقالة. رقم ٣٢٢ لسنة ٢٠١٨
التصنيف: أبحاث كيميائية
تعليق المترجم : قصة ملهمة تتناول أساليب تنكلوجية لآنتاج أدوية علاجية يستخدمها البعض منا بشكل يومي
Brian Bachmann
October 4, 2018
Professor of Chemistry, Vanderbilt University
كرم الفائزون الثلاثة بجائزة نوبل في الكيمياء لعام ٢٠١٨ لإختراعهم لأساليب سريعة وموثوقة "لإختراق "التطور - وهي الأساليب التي نقلت البحث العلمي وأدت بالفعل إلى علاجات دوائية أفضل ، وعمليات تصنيع كيميائية أكثر كفاءة وأكثر صديقة للبيئة ، ومزيد من الوقود الحيوي ذي جدوى اقتصادية.
وبفضل هذه الاختراعات ، ما أخذته الطبيعة في آلاف السنين ، يمكن أن يقوم به الكيميائيون في غضون أسابيع أو أقل. والأكثر من ذلك ، تشكل هذه الأساليب الحائزة على جوائز ما أعتبره أنا دليلاً نهائيًا على الأساس الجزيئي لنظرية التطور evolution التي وضعها تشارلز داروين.
قسمت جائزة نوبل في الكيمياء بين فرانسيس H. أرنولد وجورج P. سميث وغريغوري P. وينتر؛ تلقى هذان الشخصان الأخيران النصف الآخر من الجائزة. سأعترف بتحيزي اتجاه فرانسيس H. أرنولد التي كرمت تمكلوجياها لجنة نوبل - على التطور الموجهه directed evolution للانزيمات، وهي البروتينات التي تحفز التفاعلات الكيميائية - لأن الكثير من عملي البحثي قد بني على ذلك. سميث وينتر أيضا استخدما التطور evolution للتتبع السريع لتطوير بروتينات وأجسام مضادة بخصائص مرغوبة. وقد استغلوا قوة الفيروسات في زيادة حجم التطور الموجهه بشكل متسارع كما تصورتها أرنولد وقامت بتوسعتها لتطوير علاجات قائمة على البروتين مثل دواء هميرا Humira للألم المفاصل المزمن.
لشرح ذلك ببساطة، كلتا الطريقتين تولد مجموعة واسعة من البروتينات في المختبر ومن ثم تستخدمان الإنتقاء غير الطبيعي - وهو، إنتقاء البروتين بالصفات المرغوب فيها أكثر - ثم تحوير (عمل طفرة - تعديل وراثي) هذا البروتين الجديد في المختبر لجعله أفضل وأفضل. وبهذه الطريقة، يكون نسخة تطور evolution جزيئية . التطور الدارويني أدى الى خرطوم الفيل الحديث من الأنف القصير الغليظ من خلال العمليات المتكررة لطفرة الجينات الطبيعية والبقاء للأقوى . التطور الموجه يؤدي الى إنزيمات جديدة من تلك التي وجدت طبيعياً من قبل دورات تكرارية من الطفرات والإنتقاء.
البقاء للأقوى - الجزيئات
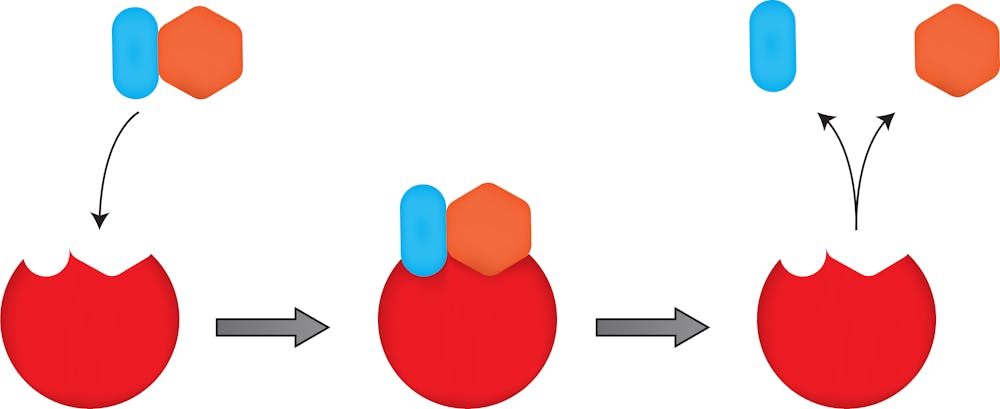
في درس الحزيئات في المدرسة الثانوية، تعلمنا مفهوم "القفل والمفتاح" للانزيمات. في هذا النموذج، الإنزيمات، والتي هي محفزات حيوية biocatalysts طبيعة والتي تسرع التفاعلات الكيميائية، هي "الأقفال" تطورت لتتربط بجزيئات الهدف الطبيعية - والتي هي "المفاتيح" -
لاستكمال التفاعل الكيميائي المعين.. لو اردت أن يقوم الإنزيم بشيء جديد، شيء غير طبيعي، كإدخال (ادراج) ذرة أكسجين في جزيء بشكل انتقائي لتصنيع دواء له قيمة، فليس من المحتمل أن تجد ذلك الإنزيم في الطبيعة.
طابع بريدي طبع في الكونغو يُبين أسلاف الفيل
لاستكمال التفاعل الكيميائي المعين.. لو اردت أن يقوم الإنزيم بشيء جديد، شيء غير طبيعي، كإدخال (ادراج) ذرة أكسجين في جزيء بشكل انتقائي لتصنيع دواء له قيمة، فليس من المحتمل أن تجد ذلك الإنزيم في الطبيعة.
تتمثل مقاربة أرنولد في أخذ إنزيم من الطبيعة ثم تحويله - من خلال التطور evolution المختبري - إلى إنزيم يؤدي تفاعلات هي مهتمة بها. وهي تقوم بذلك عن طريق أخذ الجين الذي يشفر الإنزيم ووضعه من خلال المكافئ البيولوجي للناسخة Xerox المعرضة للخطأ ، والتي تقوم بعد ذلك بتكرار الجين ملايين المرات ، لكنها تدرج الطفرات (المعدلة وراثياً) بشكل عشوائي في كل مكان.
ثم أخذت أرنولد هذه الملايين من الجينات المنسوخة بشكل سيئ وأدخلت كل واحد منها في بكتيريا مختلفة. تسمى هذه المجموعة من البكتيريا مكتبة الجينات. ولأن كل جين من هذه الجينات يتحور (يعدل وراثياً) بطريقة مختلفة ، فإن الإنزيم الذي تنتجه كل بكتيرية عندما يتم تغذيته وينمو سيكون مختلفًا بعض الشيء. ويتمثل التحدي في العثور على البكتيريا التي تحمل الانزيم بالصفات الأكثر جاذبية.
القفل (الأحمر) والمفتاح (الأزرق البرتقالي) نموذج إنزيم. في الطبيعة ، تأخذ الإنزيمات التي تناسب مفتاحًا واحدًا فقط ملايين السنين لتتطور. وجدت الدكتورة أرنولد كيف تقوم بتسريع تطور الإنزيمات لتتناسب تمامًا مع الهدف الذي كانت تحاول تغيىره. joshya / shutterstock.com
على سبيل المثال ، لنفترض أن لديك عملية صناعية تتطلب إنزيمًا يعمل في درجات حرارة عالية ، ولكن الانزيم الطبيعي يتفكك (يتكسر) في هذه الظروف القاسية. يمكنك أن تعمل الآلاف من النسخ الطافرة ( المعدلة جينياً ) العشوائية ، واختبار كل منها لمعرفة ما إذا كانت تقوم بوظائفها عند درجة الحرارة العالية ، وانتقاء الفائز منها وتكرار العملية مع الفائز. وتلك هي العملية التكرارية للطفرة والإنتقاء ، تمامًا كالتطور evolution الطبيعي.
لا يختلف الأمر عما كان يتطلبه الأمر لإستيلاد كلاب ألمانية صغيرة من ذئاب على مدى عشرات الآلاف من السنين. في هذه الحالة ، يتم استخدام التكاثر الجنسي من قبل المستولدين لعمل اختلافات في الجينات ومن ثم انتقاء الصفات التي يريدونها ، على مدى أجيال عديدة للوصول إلى سلالات كلاب مختلفة. أرنولد وجدت كيف تقوم بذلك على مستوى الإنزيم الواحد. بهذه الطريقة ، انتهى قفل الإنزيم بالتغير ليتناسب مع مفتاح جزيئي جديد.
أحد الأمثلة الأولى التي برهنت عليها أرنولد كإثبات مفهوم كان مخيفًا بعض الشيء. بدأت بإنزيم مسؤول عن مقاومة الأدوية التي تتلف أدوية البنسلين وتجبرها على التطور لتتلف جيل جديد من البنسلين ، في هذه الحالة ، تصبح مضادة حيوية (بأيلوجية) أكثر تقدما.
وبهذه الطريقة ، قامت أرنولد بتسريع الساعة التطورية لمقاومة المضادات الحيوية في أنبوب اختبار. ومنذ ذلك الحين ، تم اعتماد المبدأ نفسه للتطور الموجه لإنشاء إنزيمات لها العديد من الوظائف الجديدة المفيدة ، على سبيل المثال لتطوير إنزيمات لإنتاج الوقود الحيوي والأدوية. الأدوية التي صْنعت الآن باستخدام الإنزيمات المتولدة من التطور الموجه تشمل أدوية اتورفاستاتين - ليبتور ,atorvastatin (lipitor) (أدوية خافضة للكوليسترول) المطلوبة وأدوية السكر سيتاغلوبتين جانوڤا - sitagliptin (Januvia).
تطور بمساعدة من الفيروسات
شاركت أرنولد جائزة نوبل مع سميث و وينتر، اللذين ابتكرا طرقًا لإلصاق أو عرض "بروتينات" ومضادات أجسام ذات الأهمية على سطح جسيمات فيروسات خاصة ، والتي يطلق عليها اسم الفيروس البكتيري الملتهم bacteriophage استخدام الفيروسات بدلاً من البكتيريا ، كما عملت به أرنولد ، كانت مقاربة مختلفة لتحديد الجين الذي يشفر بروتين له خصائص ذات قيمة خاصة. هذه المقاربة مفيدة بشكل خاص لإيجاد بروتينات ترتبط بالبروتين المستهدف ، مثل هدف الدواء.
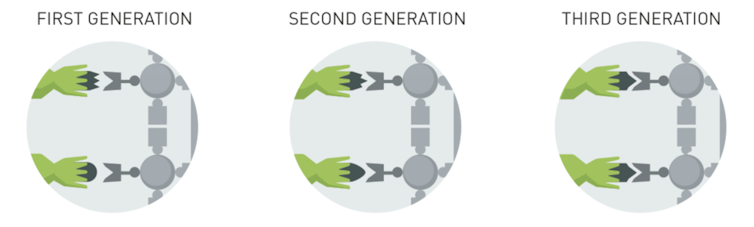
كل فيروس في مكتبة العاثيات phage (والمصطلح هذا اختصاراً ل bacteriophages وهي الفيروسات التي تصيب البكتيريا وتتكاثر بداخلها - المزيد من المعلومات في ١) يعرض بروتينًا مختلفًا على سطحه للمزيد عن الطريقة المساهمة ب phage display انظر ٢ . الفيروسات المعبرة عن البروتينات المرغوبة فيها أكثر يتم تحديدها من خلال عدة خطوات معقدة. ثم تمر الفيروسات "الفائزة" عبر دورات متعددة من الطفرات والاختبارات والإنتقاء لتنتج بروتينات تناسب وتلتصق تمامًا بهدفها.
ميزة استخدام الفيروسات في عرض البروتينات ذات الخصائص المرغوبة فيها هي عملية مصغرة لعملية الإنتقاء وتسمح لك بمعالجة ملايين الجينات المعدلة وراثياً للعثور على أفضل الجينات المناسبة للعملية ، مقارنةً بالآلاف من الجينات المتحورة (المعدلة وراثياً ) التي تستخدم البكتيريا.
كان لهذه التكنولوجيا تأثير كبير على علاج الأجسام المضادة. الأجسام المضادة هي جزيئات تستخدم نظامنا المناعي للإرتباط وقتل مسببات الأمراض والتخلص من الخلايا الميتة . لكن العلماء يستخدمونها بشكل متزايد للإرتباط بأهداف دوائية لعلاج الأمراض المختلفة. الأداليموماب Adalimumab والمعروف تحارياً باسم Humira هو مثال على الأجسام المضادة العلاجية المستخدمة في علاج التهاب المفاصل الروماتيزية.
من إنزيمات فردية إلى تعاون بين الإنزيمات المتطورة
بدأت حياتي المهنية في تركيب المواد الكيميائية ، والتي ينتج مواد كيميئية عن طريق تركيب ذرات كيميائية على بعضها في دورق مستدير القاع. هذا عمل صعب وقد أدركت أن الكائنات الحية تصنع المواد الكيميائية المعقدة بلا جهد أثناء تطورها ، لذا أردت أن أتعلم كيف أكيف المحفزات الإنزيمية الطبيعة - وهي الأدوات التي تستخدمها الحياة لتعمل الكيمياء - عملية تركيب جزيئات صناعية ( غير طبيعية) مفيدة.
مع كل جيل تال ، الأجسام المضادة تتطور وتتناسب بشكل أفضل مع البروتين المستهدف. مع كل جيل ، يصبح التناسب بين الجسم المضاد والهدف أكثر قوة وأكثر تحديدًا. يوهان يارنستاد Jarnestd / الأكاديمية الملكية السويدية للعلوم ، CC BY-SA
في أواسط تسعينات القرن الماضي ، أظهر بحث قامت به أرنولد أنه يمكننا في النهاية استخدام هذه الطريقة المستوحاة من الطبيعة للتطور الموجه لتحسين وظيفة الإنزيمات المفردة لحملها على أداء الكيمياء التي لا تستطيع القيام بها بشكل طبيعي ، وبشكل أسرع بملايين المرات ، وحملها على أداء كيمياء لا نتمكن من القيام بها بأي وسيلة.
تساءلت: إذا كان الإستحالة (التحول) البايلوجي الواحد ، تحول A إلى B ، شيئاً قويًا ، فهل يمكننا إيجاد طريقة لإنشاء مسارات لربط ثلاث أو أربع أو حتى خمس خطوات أو أكثر ، وتحويل الخطوات من A إلى E وما بعدها في أنبوب اختبار واحد ؟ إذا كان أحد العوامل المحفزة البايلوجية (الحيوية) شيئاً جيدًا ، فماذا عن خط التجميع الجزيئي داخل الخلايا لجزيء مصنع (غير طبيعي) مثل عقار الإيدز. لقد اطلقنا على طريقة مسار التطور الموجه التحول البايلوجي لإننا بدأنا بالخطوة الأخيرة وعملنا باتجاه الخطوة الأولى.
في ورقة نُشرت في مجلة نتشر كيميكال بايلوجي Nature Chemical Biology ، وصفنا كيف قمنا بعملية هندسة عكسية لخط إنتاج جزيئي متكون من خمس خطوات لتركيب دواء الإيدز الدايداتوساين Didanosine باستخدام طريقة ارنولد Arnold البكتيرية.
حاليا يصنع هذا الدواء باستخدام عمليات كيميائية مكلفة للغاية. وأثباتنا للمبدأ اظهر أن التكلفة يمكن خفضها باستخدام مادة ابتدائية starting material أقل سعراً بثلاثين ضعفاً وباستخدام الإنزيمات التي تم تركيبها من خلال التطور الموجه للقيام بهذا العمل الصعب.
أحد أكثر الأشياء إثارة بالنسبة لي حول هذا النجاح الخارق الذي حققه هذا العمل الذي فاز بجائزة نوبل هو أنه قدم دليلاً مباشراً على نظرية داروين للتطور ، على المستوى الجزيئي، من جينات إلى خواص مادية. هذه النظرية ، المدعومة بملاحظات التغيرات التدريجية في السجل الأحفوري على فترات زمنية جيولوجية ، يمكن الآن مشاهدتها في المختبر على مدى بضعة أسابيع فقط لصنع أدوات مفيدة بشكل لا يصدق تفيد البشرية.
فيديو اتصال مسؤول من جائزة نوبل بالدكتورة فرانسيس
مصادر من خارج النص:
١- https://ar.m.wikipedia.org/wiki/عاثية
٢- https://en.m.wikipedia.org/wiki/Phage_display
المصدر الرئيسي
https://theconversation.com/nobel-goes-to-chemists-who-learned-to-hack-evolution-in-the-lab-104369?utm_medium=email&utm_campaign=Latest%20from%20The%20Conversation%20for%20October%204%202018%20-%201128110108&utm_content=Latest%20from%20The%20Conversation%20for%20October%204%202018%20-%201128110108+CID_74ef4269f36cbc44d235df2d7db37baf&utm_source=campaign_monitor_us&utm_term=Nobel%20goes%20to%20chemists%20who%20learned%20to%20hack%20evolution%20in%20the%20lab
للمواضيع المترجمة السابقة يرجى زيارة المدونة على هذا العنوان؛
https://adnan-alhajji.blogspot.com/?m=1

ليست هناك تعليقات:
إرسال تعليق